陈永明教授、刘利新教授团队在合成聚多肽调控TLR9通路 研究取得重大突破
近日,中山大学材料科学与工程学院陈永明教授、刘利新教授团队在国际上第一次阐明了聚合多肽抑制NA激活TLR9的机制,该成果在《Nature Nanotechnology》上发表题为“Synthetic polypeptides inhibit nucleic acid-induced inflammation in autoimmune diseases by disrupting multivalent TLR9 binding to LL37-DNA bundles”的原创性研究论文。
机体异常炎症反应会导致炎症细胞对正常组织持续性浸润、破坏,最终导致多器官功能衰竭、甚至死亡。目前临床治疗药物主要是非甾体抗炎药、糖皮质激素、免疫抑制剂和抗TNF抗体等,存在毒副作用、影响免疫系统、价格昂贵等问题,寻求新的治疗策略是一个重大挑战。
杜克大学Bruce A. Sullenger教授和哥伦比亚大学Kam W. Leong教授等最先提出利用可结合负电游离核酸(cfNA)的阳离子聚合物抑制炎症用于红斑狼疮等疾病治疗的思路(Proc. Natl. Acad. Sci. U. S. A. 2011; Proc. Natl. Acad. Sci. U. S. A. 2016)。近几年,中山大学陈永明教授和刘利新教授证明阳离子聚合物纳米颗粒(cNP)可有效清除NA并缓解类风湿关节炎的症状(Nat. Commun. 2018; Angew. Chem. Int. Ed. 2019,Adv. Funct. Mater. 2020),采用合成模拟DNA酶降解NA达到同样功能(Adv. Funct. Mater. 2023)。进而他们将该思路拓展于银屑病(Sci. Adv. 2020;Biomaterials 2021)、糖尿病足溃疡(Biomacromolecules 2022)和创伤性脑损伤(Biomacromolecules 2023)等炎症疾病。在自然界中同样存在阳离子多肽如抗菌肽LL37,人类免疫缺陷病毒转录反式激活因子(TAT),不同阳离子多肽与NA结合产生的复合物对于TLR9的作用不同。TAT与NA的复合物抑制TLR9激活,受到TAT富含精氨酸启发,中山大学陈永明教授团队设计了纳米聚精氨酸NA清除剂(PEG-TK-NPArg),发现该聚多肽能够有效抑制NA通过TLR9引起的炎症反应。进一步机制研究发现合成的聚多肽不仅能从LL37-NA免疫复合物中竞争结合NA,而且PEG-TK-NPArg-NA复合物中NA的间距与LL37-NA形成的复合物中NA的间距相比,PEG-TK-NPArg显著压缩了DNA链段间的距离,使其不能与TLR9二聚体空腔匹配,无法诱导形成TLR9聚集体,从而阻止了炎症信号的级联放大(图1)。
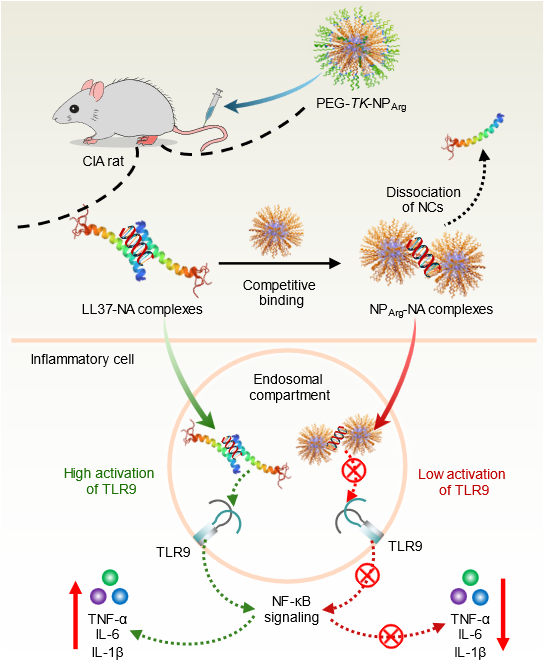
图1.合成聚精氨酸纳米颗粒通过破坏NA与TLR9之间的多价相互作用抑制NA诱导的炎症反应。
材料氨基酸组成和拓扑结构决定抗炎作用:在病理条件下,过量的NA通常会在血清或组织液中与某些自身抗体、阳离子蛋白或肽(如LL37、HMGB1和IL-26)形成免疫复合物,加重自身免疫性疾病。研究者首先探究了材料拓扑结构是否影响其对LL37-NA和HMGB1-NA复合物的清除效率。为此,研究者制备了聚精氨酸纳米粒子PEG-TK-NPArg和线性聚精氨酸PEG-TK-LArg进行对比。值得注意的是,阳离子多肽不仅不限制炎症细胞对于NA的内吞作用,PEG-TK-LArg和PEG-TK-NPArg还具有从LL37-NA或HMGB1-NA复合物中竞争结合NA的能力(图2)。而且,阳离子多肽有效抑制LL37-NA或HMGB1-NA复合物介导的炎症细胞激活。其中,PEG-TK-NPArg抑制了96%的LL37-NA或HMGB1-NA复合物诱导的TLR9激活,而PEG-TK-LArg仅导致10%的抑制(图2)。因此,聚精氨酸纳米粒子相比于线性聚精氨酸对免疫复合物诱导的炎症反应具有更有效的抑制作用。
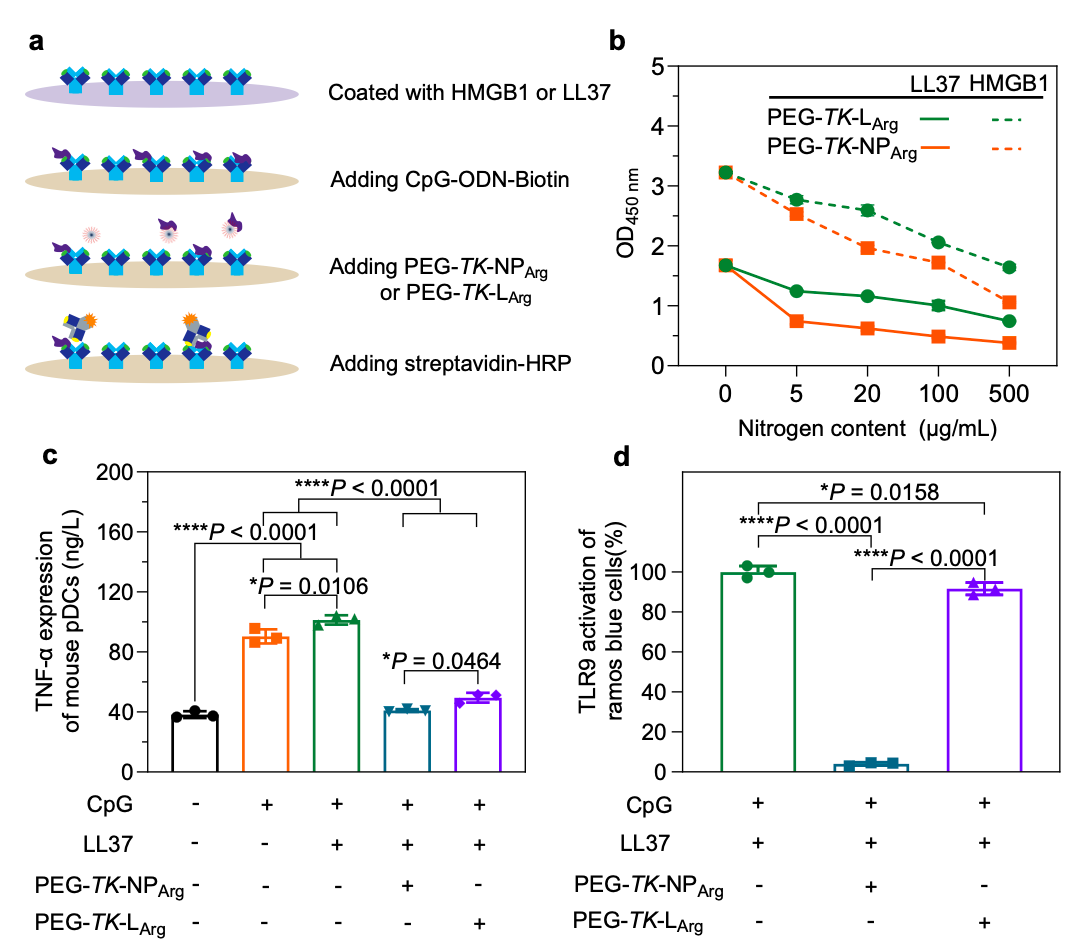
图2. PEG-TK-NPArg的体外抗炎作用。
抑制TLR9激活的机制研究:虽然上述研究证实PEG-TK-NPArg可以与NA竞争性结合形成新的复合物,从而抑制炎症细胞的活化,但其潜在的机制尚不清楚。因此,通过同步辐射小角X射线散射(SAXS),研究者研究了LL37-NA复合物和PEG-TK-NPArg-NA复合物在微结构上的差异,发现了两种复合物中DNA都存在规则周期的结构(图3)。PEG-TK-NPArg-ctDNA复合物内形成二维六边形晶格,其第一峰位置在q = 2.33 nm−1,q = 2.93 nm−1处有高阶反射,对应的NA间距为d ≈ 2.67 nm和2.08 nm,这比周期性排列的TLR9二聚体间距(~ 3.40 nm)小很多。相比之下,LL37-ctDNA复合物的结构是一个二维方形柱状晶格,第一个峰的位置在q = 1.85 nm−1,对应于一个较大的NA间距(d ≈ 3.56 nm),该尺寸可适应周期性排列的TLR9间距大小。因此,LL37-ctDNA结晶复合物使ctDNA的间距与周期性排列的TLR9间距大小相匹配,有利于募集并结合更多个TLR9聚集,导致免疫扩增;而结晶PEG-TK-NPArg-ctDNA复合物与TLR9的空间匹配性差,阻断TLR9的激活。
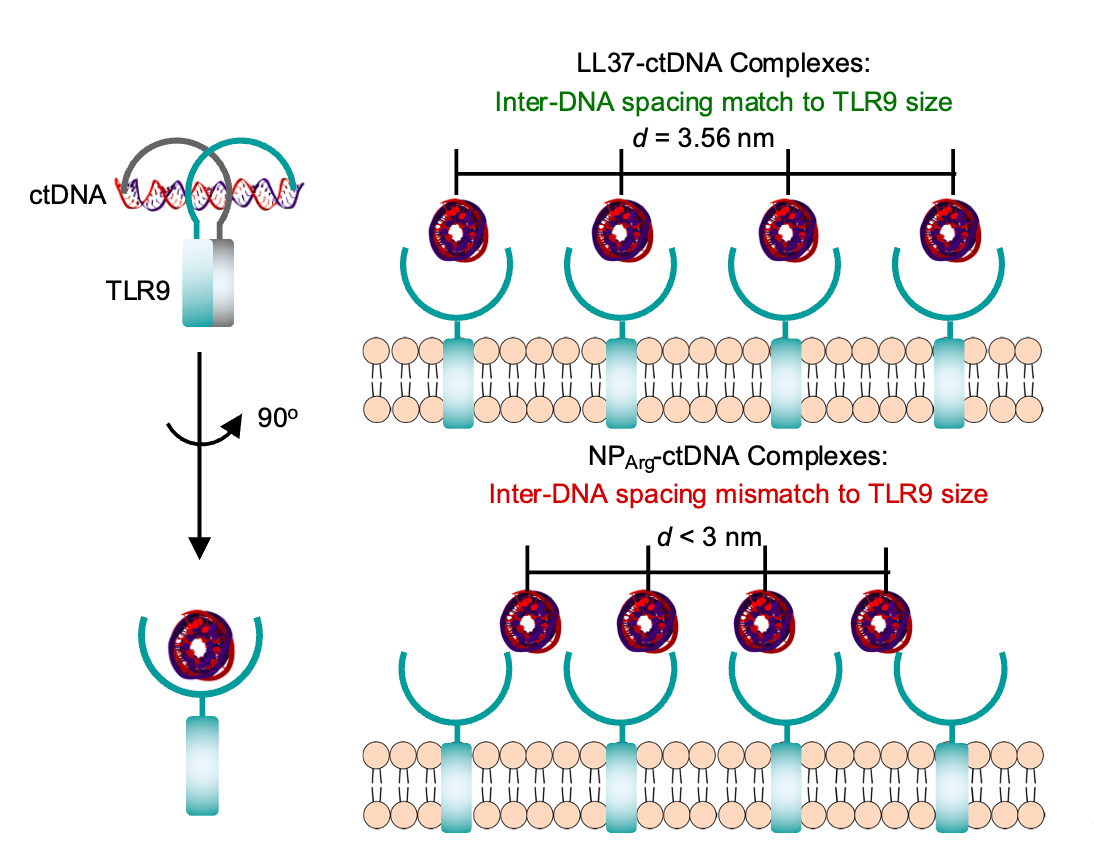
图3. 阳离子多肽对NAs与TLR9相互作用的抑制作用。
PEG-TK-NPArg的体内治疗效果:在体外环境下阳离子多肽展现出了抑制免疫复合物诱发炎症的能力,且生物相容性的PEG-TK-NPArg不会激发炎症反应。基于此,研究者进一步构建了胶原诱导性关节炎(CIA)大鼠模型,以探究阳离子多肽材料的体内抗炎效果。实验进程中,PBS处理的CIA大鼠后爪肿胀量从1.8 mL激增至2.8 mL,而PEG-TK-NPArg组大鼠的后爪肿胀程度几乎没有变化,这有力证明了PEG-TK-NPArg的治疗效果。组织学切片分析揭示,PBS处理的CIA大鼠显示出炎症细胞大量浸润及严重的软骨与骨损伤(图4)。然而,经PEG-TK-NPArg治疗的CIA大鼠症状明显缓解。因此,PEG-TK-NPArg的治疗快速降低了临床评分,有效阻止了RA关节的破坏。
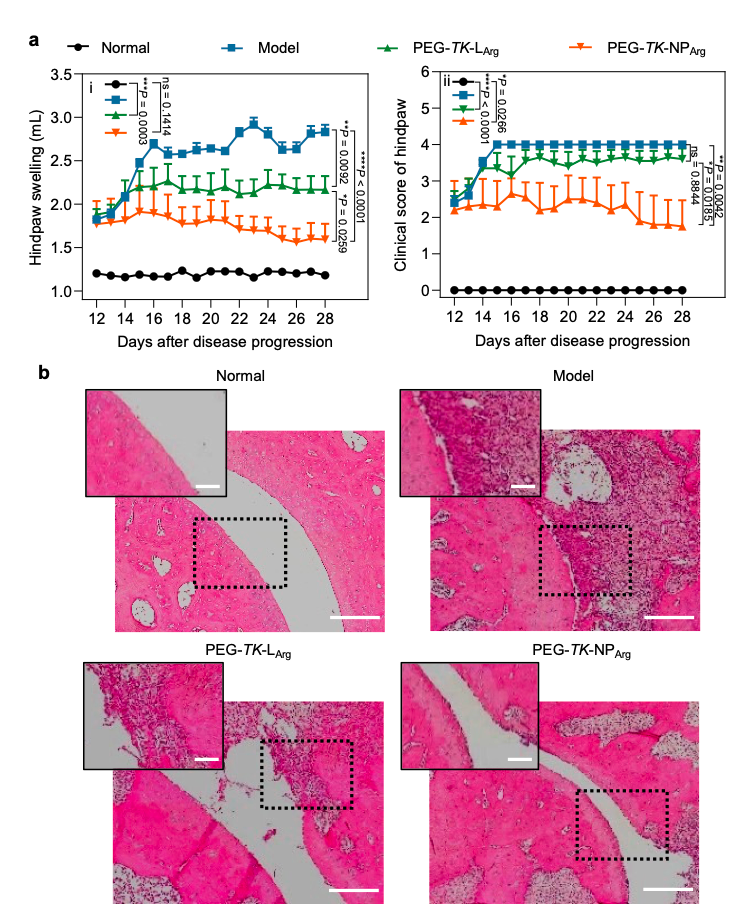
图4. 阳离子多肽对CIA大鼠的治疗和预防作用。
小结:
该文的研究者揭示了阳离子聚精氨酸纳米粒与NA形成复合物中DNA链段间距远小于LL37-NA复合物的,这个变化导致复合物中DNA链段间距不能与TLR9二聚体空腔匹配,不能诱导更多的TLR9聚集及形成下游的信号转导通路放大,从而抑制TLR9的过度激活。在胶原性关节炎大鼠模型中,研究者证实了这种纳米粒子能够显著抑制关节炎的症状。这一发现不仅深化了我们对阳离子材料抑制自身免疫疾病机制的理解,而且为开发针对游离核酸相关各种慢性和急性炎症疾病的新型治疗方案提供了有力的科学指导。另外,这种通过材料调控核酸与TLR相关作用的研究还可望为设计更有效安全的新型疫苗佐剂提供借鉴。
该研究工作是在中山大学材料科学与工程学院完成,论文第一作者为中山大学刘兴亮博士,通讯作者为中山大学陈永明教授、刘利新教授和西湖大学张越助理教授。
原文链接:https://doi.org/10.1038/s41565-024-01759-2 或 https://rdcu.be/dRkgg
初审:袁湛楠
审核:田雪林、许俊卿
审核发布:李伯军



