中山大学陈永明教授团队在肿瘤纳米佐剂领域的研究进展
淋巴结是主要的外周淋巴器官。通过载体材料将分子佐剂直接递送到淋巴结可改变佐剂的药代动力学,降低全身毒性,尤其重要的是诱导强而持久的固有免疫应答。一般被动靶向策略是将佐剂加工成纳米颗粒(10-100 nm),通过引流淋巴液转运到淋巴结中。然而,淋巴结内的囊下窦巨噬细胞和滤泡阻碍了纳米颗粒进入淋巴结深部。此外,由导管组成的网络是阻止纳米颗粒进入副皮质(主要的T细胞区)的另一个障碍。因此,避开SCS巨噬细胞的屏障,直接将纳米颗粒转运到管道中,可促进纳米颗粒向淋巴结副皮质区渗透。
单宁酸(TA)是一种来自植物多酚,可以与电负性原子形成氢键。LN导管中有丰富的弹性蛋白。因此,陈永明教授和刘利新教授团队提出使用TA修饰的纳米颗粒,可直接进入淋巴结导管并与丰富的弹性蛋白形成氢键作用,由此提高纳米颗粒在LN中的滞留时间,这可带来抗原或佐剂的持续释放,产生更有效的免疫刺激反应。本研究采用TA对负载TLR7/8激动剂咪喹莫特(imiquimod, IMQ)纳米颗粒进行修饰(图1A),联合TA修饰的负载紫杉醇(PTX)纳米粒原位释放肿瘤相关抗原(图1B)。活体实验显示TA修饰的IMQ纳米颗粒可以通过TA-淋巴结导管中弹性蛋白介导在整个淋巴结中扩散和沉积,比未修饰TA的纳米颗粒具有更强和更长的淋巴结滞留(图2A-C),从而引起强大的固有免疫反应。在小鼠三阴性乳腺癌(TNBC)模型上,TA介导的靶向递送IMQ和PTX的导管获得了强大的肿瘤特异性T细胞反应(图2E、D),并成功地阻止了肿瘤向淋巴结和肺转移(图2F、G)。
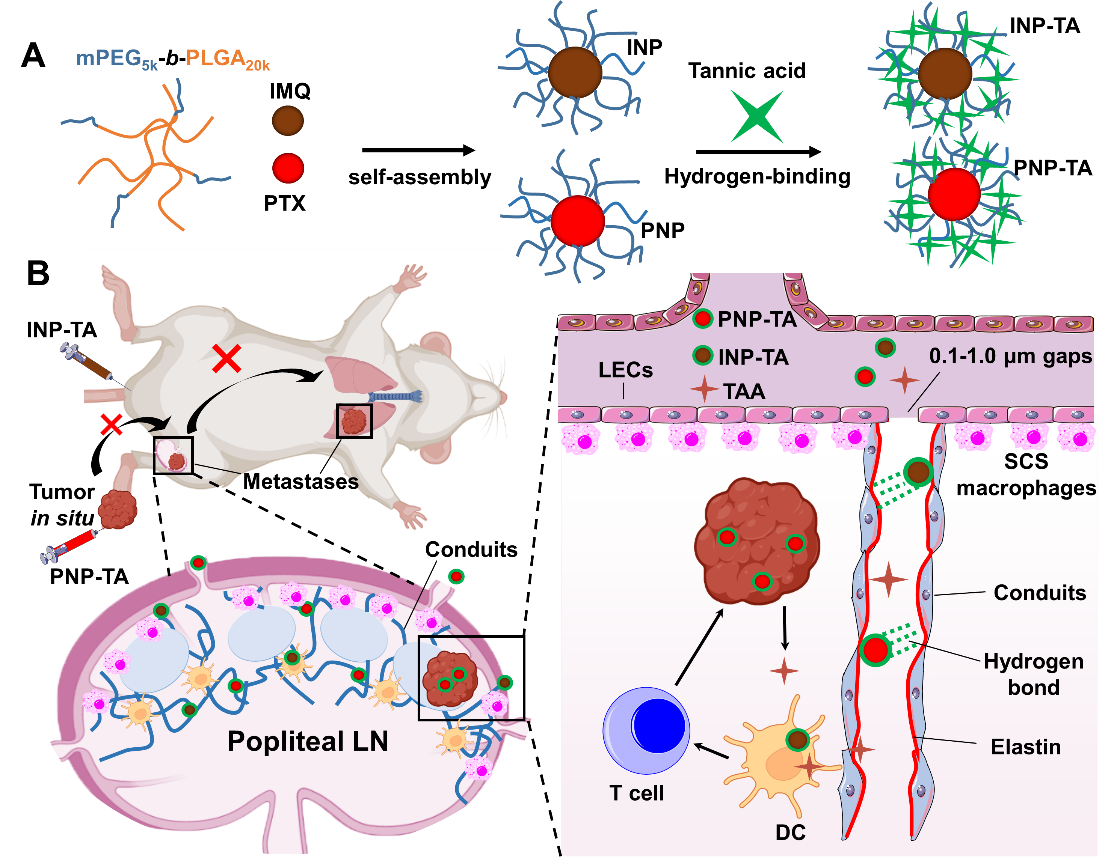
图1、(A)纳米佐剂和纳米紫杉醇的制备和(B)它们的阻断转移性乳腺癌示意图。缩写INP:负载IMQ的纳米颗粒;PNP型:负载PTX的纳米颗粒;INP-TA:单宁酸修饰的INP,PNP-TA:单宁酸修饰的PNP;TAA:肿瘤相关抗原;LECs:淋巴内皮细胞;SCS:被膜下淋巴窦。
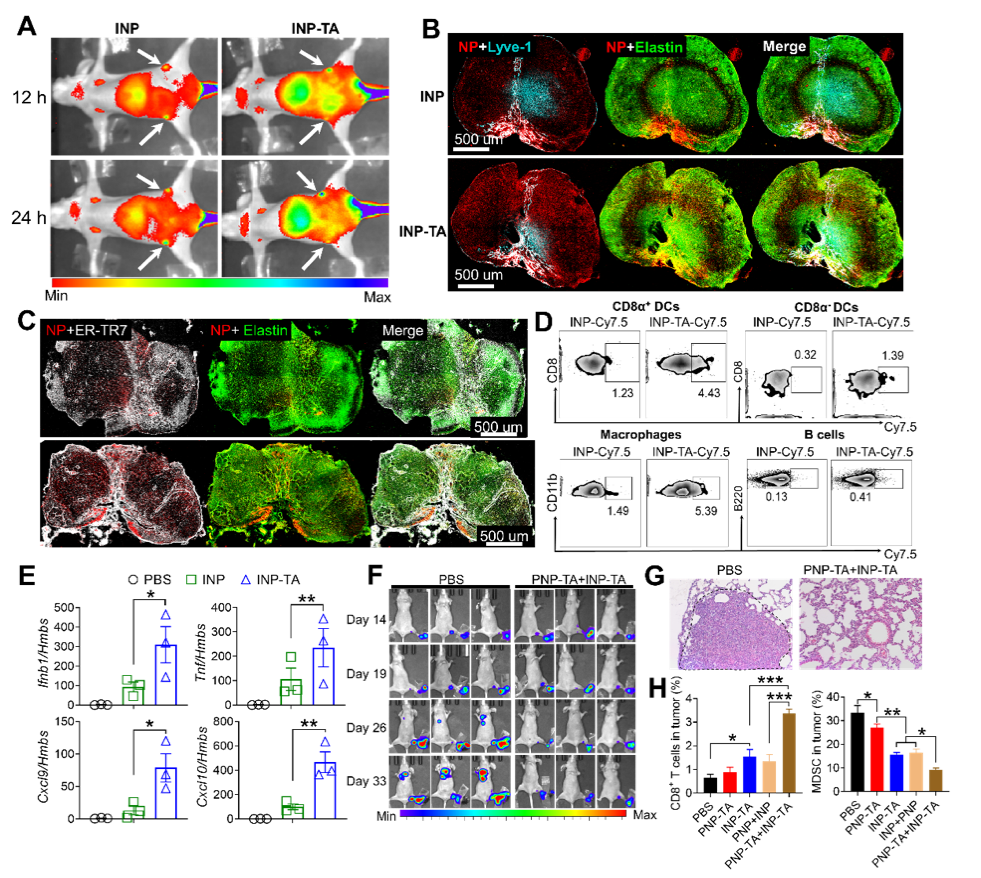
图2、(A)尾部皮下注射后INP和INP-TA在动物腹股沟淋巴结富集情况(彩色比例尺:Min=1.66×109和Max=1.52×1010(p/sec/cm2/sr)/(μW/cm2),n=3);(B,C)注射后12 h,免疫荧光共定位INP、INP-TA和淋巴管和淋巴结导管(n=3);(D)尾部皮下注射12 h后,腹股沟淋巴结中CD8α+ DCs、CD8α- DCs、巨噬细胞和B细胞的流式细胞术分析(n=3);(E)qPCR检测注射12 h后INP和INP-TA对淋巴结中Ifn-1、Tnf、Cxcl9和Cxcl10的诱导作用(n=3);(F)PNP-联合INP-TA阻止三阴性乳腺癌淋巴结转移(彩色比例尺:Min=4.42×106和Max=5.9×107 p/sec/cm2/sr)和(G)肺转移(n=3);(H)PNP-联合INP-TA促进转移灶CD8+T细胞浸润和下调MDSC浸润。
本研究将TA与LN导管中弹性蛋白高亲和的特性用于向淋巴结高效递送佐剂,并与原位释放的肿瘤相关抗原相结合,为治疗淋巴结及肺转移肿瘤疫苗的开发及接种提供了新的策略。相关成果“Nanoadjuvants Actively targeting lymph node conduits and blocking tumor invasion in lymphatic vessels”,于2022年12月1日发表在Journal of Controlled Release。该项研究得到国家自然科学基金的支持。论文链接:https://doi.org/10.1016/j.jconrel.2022.10.053
中山大学陈永明研究团队简介:该团队是广东省珠江人才计划“纳米医学工程”创新团队,研究方向为生物大分子药物递送材料和应用技术、材料对免疫系统的干预。主要成果包括:(1)采用生物材料递送蛋白/多肽抗原和分子佐剂,制备的纳米疫苗高效靶向淋巴结,产生显著体液免疫和细胞免疫。在肠道病毒感染导致的手足口病、EBV 感染引起的鼻咽癌及 HBV 引起的慢性乙肝等动物模型上效果显著;(2)开发了全新结构类型的脂质体库,研发的LNP疫苗在特定组织和器官高效安全表达,在材料和制剂上形成自主知识产权;(3)建立了蛋白、核酸纳米药物快速加工技术,解决了纳米疫苗的高重现、规模化生产的技术瓶颈;(4)通过材料抑制游离核酸引起的炎症反应和肿瘤转移,在一些慢性、急性炎症反应和肿瘤转移取得显著效果。
初审:袁湛楠
审核:田雪林、许俊卿
审核发布:李伯军



