中山大学陈永明教授团队报道无载体亚单位纳米疫苗放大机体对肿瘤和病毒感染的免疫反应
纳米载体由于其可调控的物理化学特性被广泛用于疫苗输送平台。目前,大部分纳米疫苗使用附加材料来递送抗原和佐剂,但许多问题包括纳米颗粒的理化性质和质量控制,特别是当纳米颗粒涉及到其大规模和可重复合成的多步骤或复杂技术时,限制了其临床应用。因此,开发简单而安全的制备工艺变得越来越迫切。基于此,中山大学陈永明教授团队通过亚单位抗原和TLR1/TLR2激动剂Diprovocim之间的π-π堆积和氢键作用力简单快速地制备了无载体亚单位纳米疫苗。与传统的纳米疫苗相比,该体系不需要额外的载体材料,增加了疫苗的安全性。此外,该制备方法简单、可控、可重复,有望应用于其他疫苗领域。本研究制备得到的无载体纳米疫苗具有较窄的尺寸分布,可以在小鼠皮下注射后靶向淋巴结并引起强的免疫反应。基于鸡卵白蛋白(OVA)的无载体亚单位纳米疫苗可以在小鼠体内激发强的抗体滴度和细胞免疫反应,并在与抗PD1联合治疗黑色素瘤时表现出了强大的肿瘤抑制作用。同时,含有水痘带状疱疹病毒(VZV)糖蛋白E(gE)的无载体亚单位纳米疫苗也显示了强大的体液和细胞免疫反应。因此,通过π-π堆积和氢键作用力能够快速简单地制备含有抗原和佐剂的无载体纳米疫苗,为开发抗击各种癌症和病毒感染的纳米疫苗提供了一种新的方法。
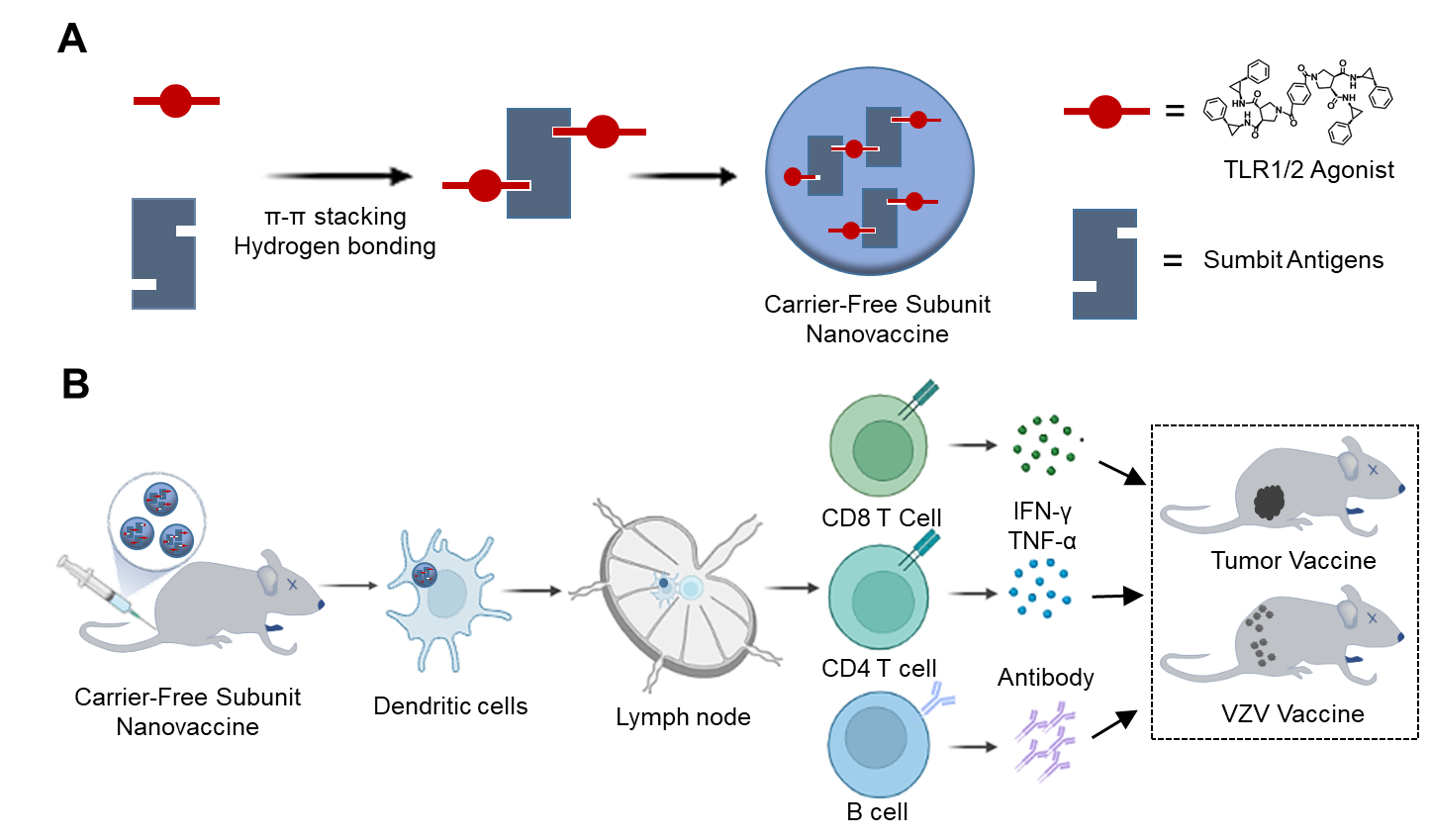
图1. 基于亚单位抗原和TLR1/TLR2激动剂Diprovocim之间的π-π堆积和氢键作用力制备的无载体纳米疫苗及其应用示意图
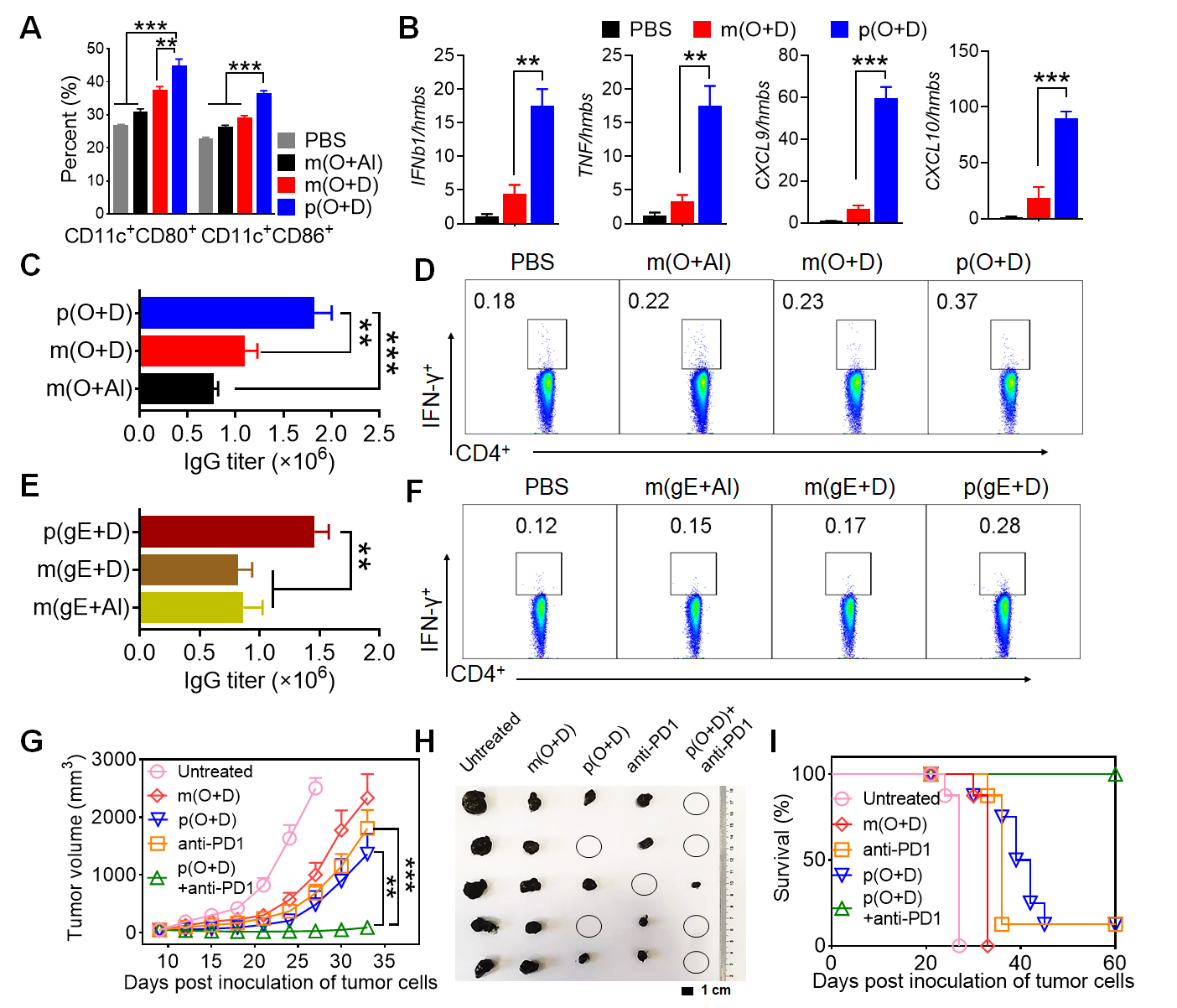
图2. (A)定量分析BMDCs上共刺激分子CD80和CD86表达(n = 3);(B) 接种后36小时qPCR检测腹股沟淋巴结中IFNb1、TNF、CXCL9和CXCL10的表达(hmbs为内参n = 3); (C)定量检测第42天产生的OVA特异性IgG、IgG1、IgG2c抗体滴度(n=10);(D) 流式细胞术分析免疫第32天小鼠血液中CD4+细胞表达的IFN-γ的量(n=10);(E)定量检测第42天产生的VZV gE特异性IgG、IgG1、IgG2c抗体滴度(n=10);(F) 流式细胞术分析免疫第32天小鼠血液中CD4+细胞表达的IFN-γ的量(n=10);(G)不同治疗组的肿瘤生长曲线(n=8);(H)不同治疗组的肿瘤的代表图片(n=5);(D) 不同治疗组的肿瘤小鼠的生存曲线(n=8)。
该研究论文以题目为“Carrier-free subunit nanovaccine amplifies immune responses against tumors and viral infections”于2022年12月23日发表在Acta Biomaterialia,中山大学材料科学与工程学院博士研究生陈浩林为本论文第一作者,陈永明教授、刘鸿博士后、刘利新教授为共同通讯作者,文章链接为https://doi.org/10.1016/j.actbio.2022.12.042
初审:袁湛楠
审核:田雪林、许俊卿
审核发布:李伯军



