中山大学陈永明、刘利新报道阳离子聚氨基酸材料可通过破坏中性粒细胞胞外诱捕网来抑制肿瘤转移
背景介绍
肿瘤的远处转移是导致癌症患者死亡最主要的原因。目前传统治疗手段如化疗等可以减小原位肿瘤大小,但对肿瘤转移的抑制效果甚微,迫切需要发展新的治疗策略来抑制肿瘤转移以降低肿瘤导致的高死亡率。最近的研究表明[1],中性粒细胞胞外捕获网(Neutrophil Extracellular Traps, NETs)中的DNA(NET-DNA)可被肿瘤细胞膜上的DNA感受器CCDC25识别而介导肿瘤细胞从原发部位到远端器官的转移。在乳腺癌和结肠癌的病人中,容易发生肿瘤转移的部位如肝脏和肺部都有大量积聚的NET,这说明NET与肿瘤转移有着密不可分的关系,NET也因此可望成为抑制癌症远端转移的新靶点。
文章亮点
近日,中山大学陈永明教授和刘利新教授团队报道了阳离子聚氨基酸纳米颗粒(cANP)通过破坏中性粒细胞胞外诱捕网抑制肿瘤转移的研究发现。该团队之前采用阳离子聚合物材料清除游离核酸来抑制游离核酸引起的炎症反应[2,3]。本项研究采用了生物安全性更好的聚氨基酸作为材料,通过叔胺基修饰提供材料结合DNA的能力。纳米颗粒化的阳离子型聚天冬氨酸材料cANP相较于线性聚合物PAsp有更好的肝脏滞留效果,有更高的竞争结合NET-DNA的能力来阻断NET-DNA与CCDC25的结合,从而更有效地抑制肿瘤细胞向远端器官的迁移,因此显示出更卓越的抑制体内肿瘤转移的效果(图1)。
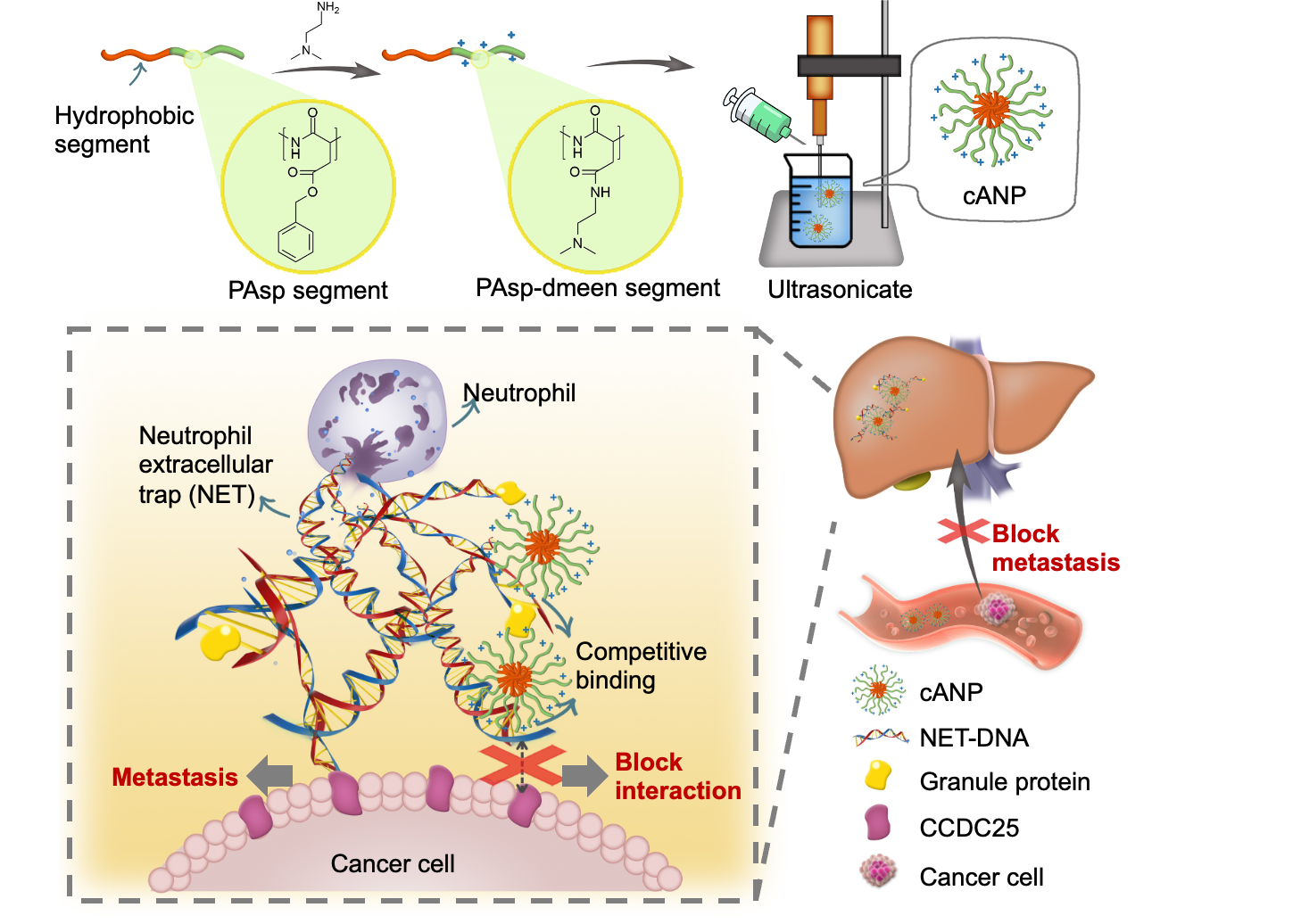
图1. cANP的制备和通过结合NET-DNA抑制NET诱导的肿瘤转移的示意图
该文章采用NCA开环聚合制备聚天冬氨酸化合物,并通过与二乙基乙二胺的胺解反应来调节聚天冬氨酸的胺解程度(10%,50%,100%)。cANP则是由100%胺解后的聚天冬氨酸的嵌段共聚物自组装而制备(图1)。由于纳米颗粒化的cANP-100%有着比线性聚合物PAsp-100%更高效的DNA结合效率,cANP-100%可以更好地从CCDC25中竞争结合NET-DNA,阻止NET-DNA与CCDC25的结合,并且破坏NET的形成,从而更好地抑制了由NET-DNA诱导的人乳腺癌细胞MDA-MB-231的细胞骨架变形、粘附、迁移和趋化的能力(图2)。
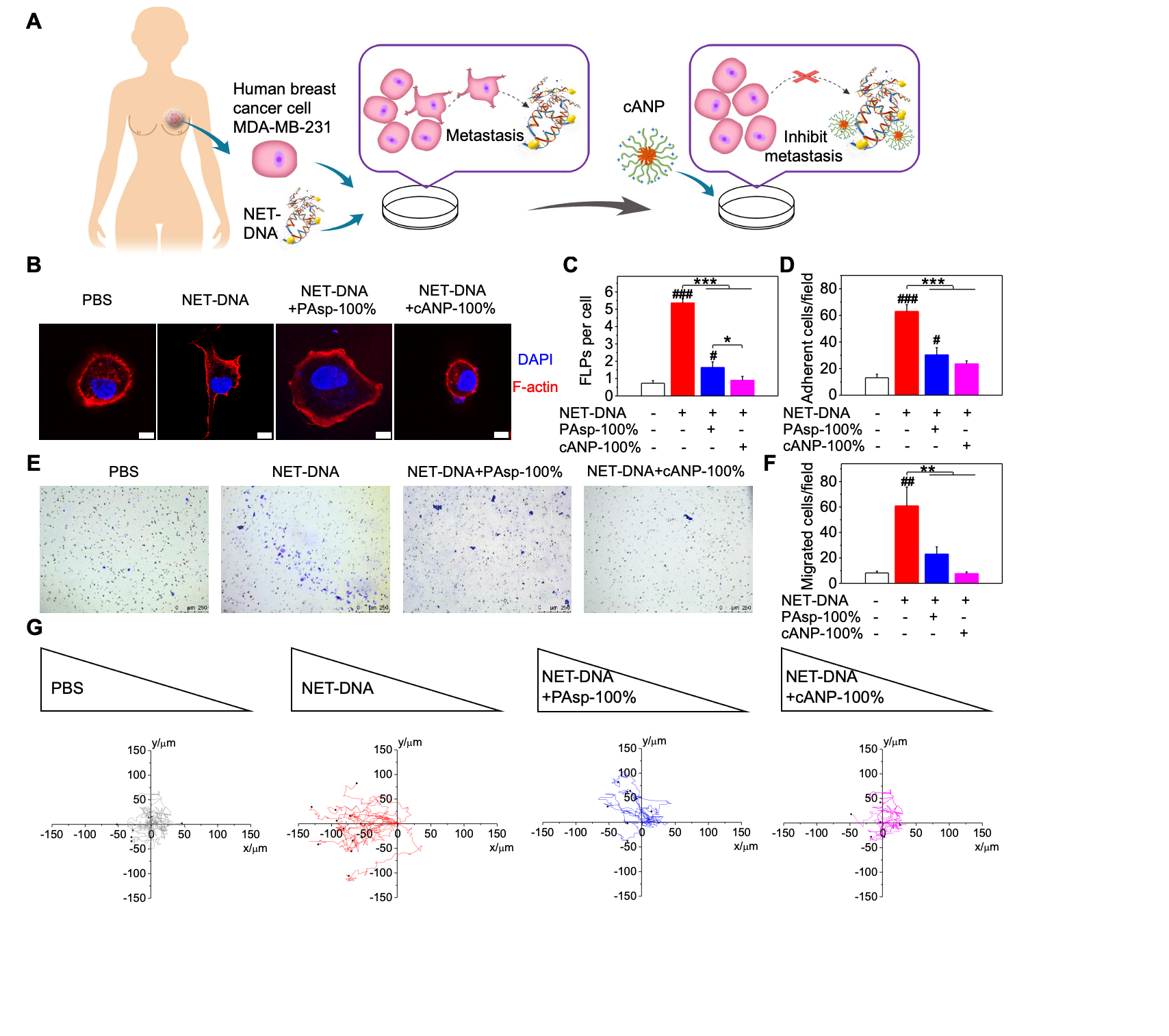
图2. cANP 抑制人乳腺癌肿瘤细胞中由NET-DNA诱导的细胞趋化功能。(A)cANP通过结合NET-DNA抑制NET介导的人乳腺癌细胞转移的示意图;(B-C)阳离子聚氨基酸材料中和NET-DNA抑制NET-DNA诱导的癌细胞骨架变形(B-C)、癌细胞粘附(D)、癌细胞迁移(E-F)与癌细胞趋化能力(G)。
相较于PAsp-100%而言,纳米颗粒 cANP-100%在肝脏有更多的富集量。因此,cANP-100%可更有效地中和并破坏导致肿瘤转移至肝脏器官的NET-DNA,同时降低体内循环中NET-DNA的含量,使得其他易发生转移的器官如肺部也有更低含量的NET积累(图3)。

图3. 在肝脏有更好积累的cANP能更好地减少小鼠原位乳腺癌模型局部NET的浸润以及血清中NET-DNA的含量。(A-B)72小时PAsp-100%与cANP-100%在体内的分布情况;(C-F)不同组别中NET在乳腺癌模型肝脏(C, E)和肺部(D,F)的浸润情况;(G) 血清中MPO-DNA的浓度。
凭借着优良的DNA结合能力与肝积累的能力,cANP-100%比PAsp-100%更好地抑制了体内肿瘤细胞向肝脏及肺部的转移。在4T1小鼠乳腺癌原位肿瘤模型、HCT116人结肠癌转移瘤模型以及MDA-MB-231人乳腺癌原位肿瘤模型中,cANP-100%都更有效减少肝脏和肺部的肿瘤结节数,降低了肿瘤细胞在这些远端器官的浸润。值得一提的是cANP-100%的治疗还有效延长了MDA-MB-231人乳腺癌原位瘤模型的寿命,显著提高了生存率,这在临床上具有很大现实意义(图4)。
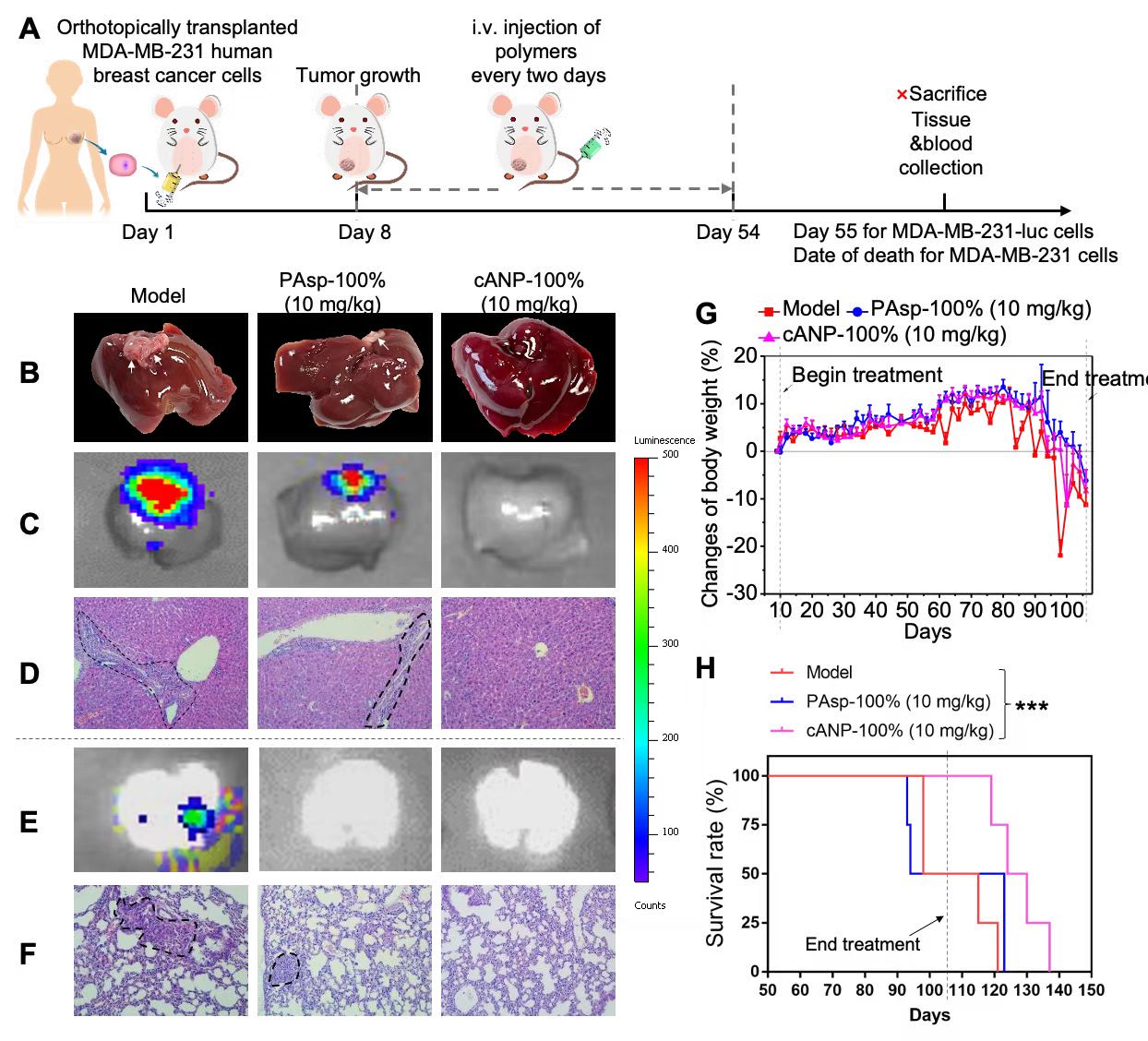
图4. cANP-100%的治疗有效减少MDA-MB-231人乳腺癌原位模型中癌细胞的肝转移和肺转移。(A)MDA-MB-231原位乳腺癌模型的实验流程图;(B)cANP-100%的治疗有效减少肝肿瘤结节数;(C)luminescence图显示cANP-100%有效抑制MDA-MB-231-luc肿瘤细胞向肝脏的迁移;(D)HE组织切片显示cANP-100%治疗后肝脏没有明显的肿瘤细胞浸润;(E)luminescence图显示阳离子聚天冬氨酸材料都有效抑制MDA-MB-231-luc肿瘤细胞向肺部的迁移;(F)HE组织切片显示cANP-100%组肺部没有明显的肿瘤细胞浸润;(G)治疗过程中小鼠的体重变化(H)cANP-100%的治疗有效延长肿瘤小鼠的生存期。
总结/展望
这项工作揭示了聚氨基酸阳离子材料可以通过中和并清除NET-DNA,来阻断NET-DNA介导的肿瘤转移。其中纳米颗粒化的材料cANP有更好的肝脏聚集效果和结合DNA能力,可更好地降低肝脏的NET-DNA水平,从而减少了肿瘤细胞向肝脏的转移。同时cANP也降低了血液中NET-DNA和其他容易发生转移的器官如肺部的NET-DNA水平,从而抑制这些器官中的肿瘤转移。需要强调的是,这个治疗理念也在人源乳腺癌原位移植模型中得到证实,并体现出延长癌症小鼠生存期的效果。该研究通过合成的聚氨基酸材料清除趋化因子NET-DNA来阻断癌症转移的秘密通道,为抑制肿瘤的远端转移提供了简单、安全、高效的新策略。
该研究成果以题目为“Nanoparticulate cationic poly(amino acid)s block cancer metastases by destructing neutrophil extracellular traps”于2023年1月17日发表在国际学术期刊《ACS Nano》,文章链接https://pubs.acs.org/doi/pdf/10.1021/acsnano.2c11280。
中山大学陈永明研究团队简介:该团队是广东省珠江人才计划“纳米医学工程”创新团队,研究方向为生物大分子药物递送材料和应用技术、材料对免疫系统的干预。主要成果包括:(1)采用生物材料递送蛋白/多肽抗原和分子佐剂,制备的纳米疫苗高效靶向淋巴结,产生显著体液免疫和细胞免疫。在肠道病毒感染导致的手足口病、EBV 感染引起的鼻咽癌及 HBV 引起的慢性乙肝等动物模型上效果显著;(2)开发了全新结构类型的脂质体库,研发的LNP疫苗在特定组织和器官高效安全表达,在材料和制剂上形成自主知识产权;(3)建立了蛋白、核酸纳米药物快速加工技术,解决了纳米疫苗的高重现、规模化生产的技术瓶颈;(4)通过材料抑制游离核酸引起的炎症反应和肿瘤转移,在一些慢性、急性炎症反应和肿瘤转移取得显著效果。
参考文献:
- Yang, L. B.; Liu, Q.; Zhang, X. Q.; Liu, X. W.; Zhou, B. X.; Chen, J. N.; Huang, D.; Li, J. Q.; Li, H. L.; Chen, F.; Liu, J.; Xing, Y.; Chen, X. M.; Su, S. C.; Song, E. W. DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25. Nature 2020, 583, 133-138.
- Liang, H. Y.; Peng, B.; Dong, C.; Liu, L. X.; Mao, J. J.; Wei, S.; Wang, X. L.; Xu, H. S.; Shen, J.; Mao, H. Q.; Gao, X. H.; Leong, K. W.; Chen, Y. M. Cationic nanoparticle as an inhibitor of cell-free DNA-induced inflammation. Nat. Commun. 2018, 9, 4291.
- Liu, X. L.; Liang, H. Y.; Yan, Y. Z.; Wu, J. J.; Bottini, M.; Liu, L. X.; Chen, Y. M. The protein corona modulates the inflammation inhibition by cationic nanoparticles via cell-free DNA scavenging. BioAct. Mater. 2022, 13, 249-259.
初审:袁湛楠
审核:田雪林、许俊卿
审核发布:李伯军



