中山大学陈永明教授团队在纳米佐剂递送技术的研究进展
免疫佐剂是用于增强疫苗抗原免疫原性的物质,研究和应用实践证明佐剂对于疫苗持久和有效的免疫应答、降低抗原剂量具有重要作用。传统铝佐剂对激起疫苗抗体滴度具有很好作用,但是对于需要细胞免疫的疫苗则没有作用。基于细胞Toll样受体和NOD样受体相关新型佐剂则能够有效激活天然免疫,这对于基于蛋白/多肽抗原、需要细胞免疫的疫苗非常重要。大多数新型佐剂属于小分子或易降解物质,存在进入血液产生系统炎症反应、易被体内酶降解、难入细胞等问题,严重影响了实际应用。纳米递送技术可望解决新型佐剂这些问题,并且能提高佐剂免疫刺激能力,在疫苗应用中发挥重要作用。
CpG ODN是一类CpG寡核苷酸,可激活细胞TLR9产生有效的Th1细胞,带来B细胞和T细胞的活化。中山大学研究团队采用FDA批准的鱼精蛋白和三聚磷酸(TPP)为递送材料,通过自主研发的快速纳米复合加工技术,将CpG和递送材料通过简单的电荷作用,制备了直径约70纳米、分布均匀的CpG纳米颗粒佐剂(npCpG)(图a)。研究结果表明该纳米佐剂可有效增加CpG在淋巴结中的富集,减少系统性扩散,进而提高其有效性和安全性(图b和c)。团队研究了该纳米佐剂的配伍蛋白抗原的性能,结果表明npCpG配伍疫苗具有高体液和细胞免疫,在感染性疾病预防和肿瘤免疫治疗中均显示出优异的免疫刺激能力,可显著增强H1N1 血凝素抗氧(HA)和OVA抗原的免疫原性,发挥抗感染和抗肿瘤的作用,显示出该佐剂良好的通用性(图d-f)。
该研究采用的材料简单安全,制备纳米佐剂的加工技术高可控性、高重现性、可规模化,可灵活配伍不同抗原组成疫苗,因此该项研究成果具有临床转化的前景。
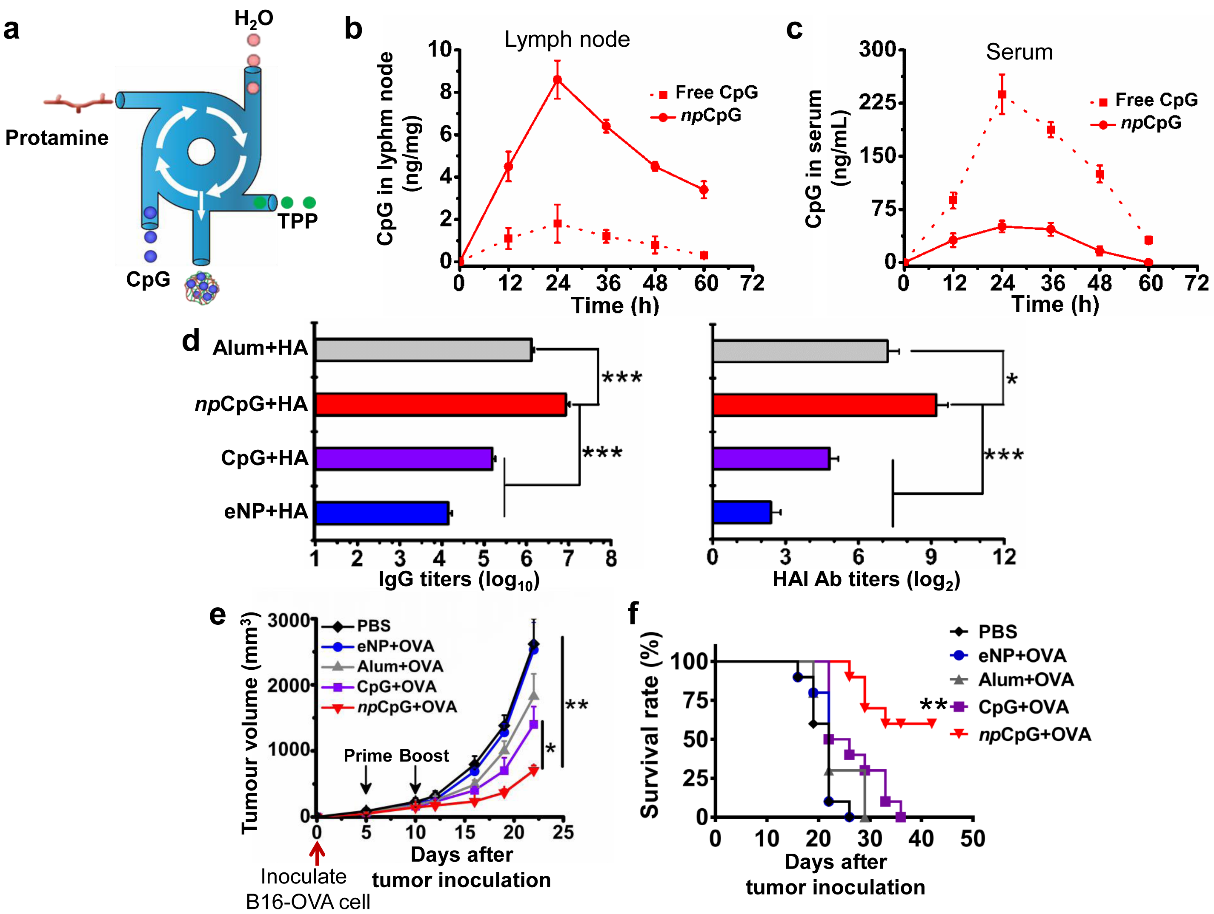
图. (a)通过FNC制备npCpG示意图。npCpG皮下注射后在(b)淋巴结和(c)血液中的代谢动力学。(d)npCpG 联合流感HA抗原免疫BALB/c小鼠后显著提升总抗体(IgG)和血凝抑制抗体(HAI)滴度。npCpG联合OVA抗原免疫C57BL/6J后(e)显著抑制肿瘤生长和(f)提高荷瘤小鼠的生存率。对比组:游离CpG,铝剂,空颗粒。
该研究成果以“ Universal and Translational Nanoparticulate CpG Adjuvant”为题目,于2022年11月5日发表在ACS Applied Materials & Interfaces ( DOI: 10.1021/acsami.2c15644),乔冬冬博士后为第一作者(现为汕头大学医学院副研究员),刘利新和陈永明教授为共同通讯作者。该工作得到国家自然科学基金、广东省创新创业研究团队项目和广州市重点领域研究计划项目支持。
论文链接:https://pubs.acs.org/doi/10.1021/acsami.2c15644
中山大学陈永明研究团队简介:该团队是广东省珠江人才计划“纳米医学工程”创新团队,研究方向为生物大分子药物递送材料和应用技术,为新型疫苗和佐剂提供解决方案。主要成果包括:(1)采用生物材料递送蛋白/多肽抗原和分子佐剂,制备的纳米疫苗高效靶向淋巴结,产生显著体液免疫和细胞免疫。在肠道病毒感染导致的手足口病、EBV 感染引起的鼻咽癌及 HBV 引起的慢性乙肝等动物模型上效果显著;(2)开发了全新结构类型的脂质体库,研发的LNP疫苗在特定组织和器官高效安全表达,在材料和制剂上突破海外专利;(3)建立了蛋白、核酸纳米药物快速加工技术,解决了纳米疫苗的高重现、规模化生产的技术瓶颈。
初审:袁湛楠
审核:田雪林、许俊卿
审核发布:李伯军



